作者:安法醫新抗老科學研究中心 研發長 吳杰浩
(歡迎分享與引用,請註明出處:#安法醫新抗老科學研究中心,謝謝)
2025 年諾貝爾生理醫學獎頒給了 Mary E. Brunkow、Fred Ramsdell 與 Shimon Sakaguchi,以表彰他們對 「周邊免疫耐受(peripheral immune tolerance)」 機制的開創性發現。(圖一)
他們揭示了免疫系統如何避免攻擊自身的「煞車機制」——調節性 T 細胞(Regulatory T cells, Tregs)。這項發現不僅改變了免疫學的基礎理論,也為抗老化醫學帶來新的理解與應用方向。

圖一:2025 年諾貝爾生理醫學獎頒給了 Mary E. Brunkow、Fred Ramsdell 和 Shimon Sakaguchi,表彰他們在 「周邊免疫耐受(peripheral immune tolerance)」 的發現。
圖片來源:The Nobel Prize in Physiology or Medicine 2025 – Advanced Information, Nobel Assembly at Karolinska Institutet.
一、免疫系統的煞車:什麼是免疫耐受
免疫系統的任務是辨識並消滅外來入侵者,如病毒與細菌。然而,如果免疫系統誤判「敵我」,就會攻擊自身組織,引發紅斑性狼瘡、第一型糖尿病或類風濕性關節炎等疾病。
為了避免這種「誤傷自己」的情況,人體建立了兩道保護機制。
第一道是「中央免疫耐受」,發生在胸腺與骨髓,主要負責刪除對自身反應過強的免疫細胞;
第二道是「周邊免疫耐受」,分布於血液與外周組織,由調節性 T 細胞(Tregs)進行控制。(圖二)
Tregs 的功能就像煞車系統,它們能主動抑制過度免疫反應,防止免疫系統「誤開火」。當這套煞車失靈時,便會導致慢性發炎、自體免疫疾病與組織老化。
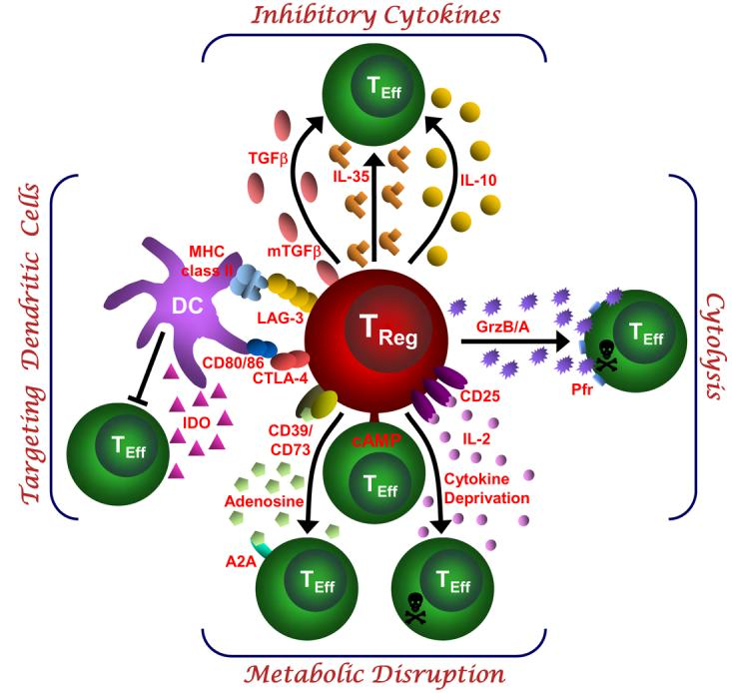
圖二:Tregs 如何維持自我耐受
調節性 T 細胞(Treg)抑制免疫反應的四大路徑整合:①抑制性細胞激素(IL-10、IL-35、TGF-β),②細胞溶解(Granzymes/Perforin),③代謝干擾(奪取 IL-2、cAMP、CD39/CD73→腺苷-A2A),④作用於樹突細胞(CTLA-4、LAG-3→下調共刺激、誘導 IDO),完整呈現「免疫煞車」如何落實自我耐受。
圖片來源: Nat Rev Immunol. 2008 July ; 8(7): 523–532.
二、三位得主的關鍵發現
日本學者 坂口志文(Shimon Sakaguchi) 在 1995 年首次發現,一群表現 CD25 的 T 細胞具有抑制免疫攻擊的能力,他將其命名為「調節性 T 細胞」。
這是人類第一次證明免疫系統中存在一個「自我抑制」的細胞族群。
隨後,美國的 Mary E. Brunkow 與 Fred Ramsdell 在 2001 年發現,
當一種名為 FOXP3 的基因突變時,無論在小鼠或人類,都會出現嚴重自體免疫疾病。他們證明 FOXP3 是 Tregs 的主控基因,決定免疫系統是否能維持平衡。
這三位學者的發現串連起來,建立了今日免疫學的核心概念:「免疫耐受的關鍵在於 Tregs 與 FOXP3 軸線的穩定」。
三、免疫耐受與抗老化的關聯
這項發現表面上屬於免疫學,但其深層意義與老化密切相關。
隨著年齡增長,免疫系統出現兩大改變:
第一,是「慢性低度發炎」(inflammaging),身體長期處於輕度發炎狀態,促進糖尿病、心血管與神經退化疾病。
第二,是「免疫耐受的喪失」,即調節性 T 細胞數量與功能下降,使免疫系統更容易誤傷自身組織。
換言之,免疫老化並非免疫力減弱,而是免疫平衡崩壞。免疫系統變得既遲鈍又暴躁,這種失衡正是老化與慢性病的根本來源。(圖三)
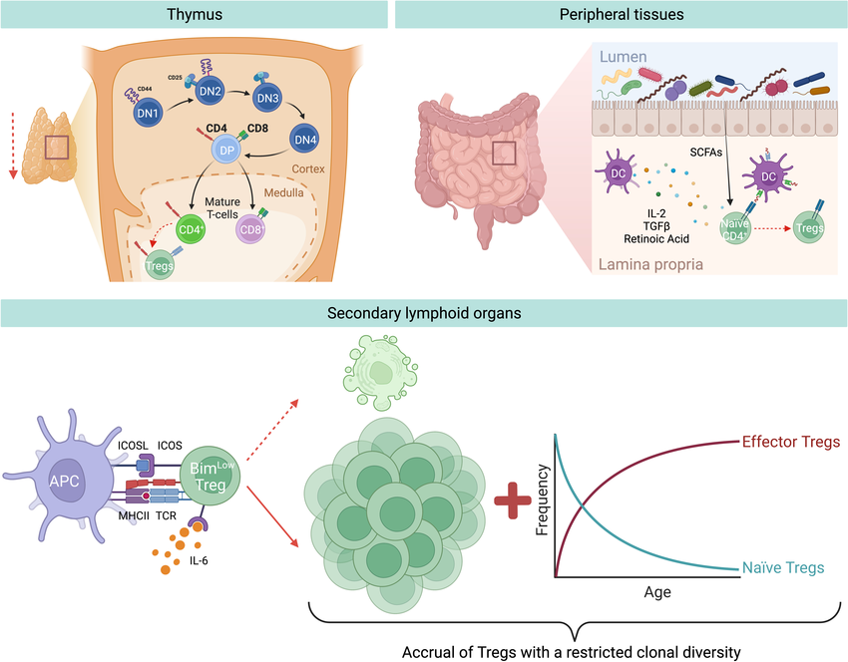
圖三:Treg 隨年齡變化與來源.
老化使胸腺萎縮降 tTreg;腸道誘導 pTreg 補位,淋巴訊號促增殖;最終初始 Treg 減、效應 Treg 增,克隆多樣性變窄、功能易失衡。
圖片來源:Front Immunol. 2022 Aug 9:13:940705.
四、FOXP3 與 Tregs 的抗老化作用
越來越多證據顯示,Tregs 與 FOXP3 在抗老化中扮演多重角色:
首先,它們能抑制慢性發炎。
Tregs 透過釋放 IL-10 與 TGF-β,減少炎症與氧化壓力,維持組織穩定。
其次,它們保護幹細胞再生微環境。
在肌肉、皮膚與骨髓中,Tregs 能防止慢性發炎導致纖維化,維持幹細胞活性與修復能力。
第三,它們影響腸道與神經系統的平衡。
腸道益生菌(如長雙歧桿菌與酪酸菌)能誘導 FOXP3 表達,促進 Tregs 增生,進而降低系統性發炎;同時,Tregs 也能抑制腦部微膠質細胞的過度活化,減緩神經退化與記憶下降。
五、臨床應用與抗老化策略
科學家正嘗試透過多種方式「重啟免疫耐受」:
第一,低劑量 IL-2 療法可選擇性活化 Tregs,目前已用於紅斑性狼瘡、糖尿病等臨床試驗。
第二,間質幹細胞與外泌體含有 TGF-β、miR-155 等分子,能誘導免疫耐受並改善慢性發炎。
第三,腸道益生菌(如長雙歧桿菌、L. rhamnosus、酪酸菌)可透過腸–免疫軸增加 FOXP3 表達。
第四,營養與代謝干預,如維生素 D、Omega-3、白藜蘆醇與 NMN,可間接提升免疫平衡。
這些策略的共同目標是:維持免疫平衡、降低慢性發炎、延緩老化進程。
六、免疫平衡是長壽的關鍵
傳統的抗老化觀點多集中於抗氧化、修復與再生,而 2025 年的諾貝爾獎提醒我們:
「延壽的前提是免疫系統要懂得克制。」
FOXP3–Tregs 軸線讓我們看到,長壽不僅取決於免疫防禦力強弱,更取決於免疫反應的「節奏與分寸」。真正的抗老化醫學,是讓身體在防禦與修復之間保持和諧,讓免疫系統既能保護,也能容忍。
2025 年的諾貝爾醫學獎不只是免疫學的榮耀,更揭開了抗老化的核心祕密。
青春與長壽,不只是修復組織的速度,而是免疫系統能否懂得「何時該出手,何時該停手」。
參考文獻:
- The Nobel Prize in Physiology or Medicine 2025 – Advanced Information, Nobel Assembly at Karolinska Institutet.
- Brunkow M.E. et al. Disruption of FOXP3 results in fatal autoimmune disorder in scurfy mice. Nature Genetics, 2001.
- Bennett C.L. et al. IPEX is caused by mutations of FOXP3. Nature Genetics, 2001.
- Sakaguchi S. et al. Regulatory T Cells and Immune Tolerance. Nature Reviews Immunology, 2020.
- FOXP3+ Tregs maintain tissue homeostasis and stem cell function in aging. Cell Metabolism, 2021.
- Regulatory T cells mitigate neuroinflammation and cognitive decline in aging. Nature Aging, 2023.

